
题目列表(包括答案和解析)

工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
NH3 + CO2 + H2O + NaCl(饱和) ![]() NaHCO3(晶体)↓+ NH4Cl
NaHCO3(晶体)↓+ NH4Cl
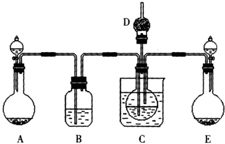
(1)某校学生实验小组利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体。C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
可选用的药品有:a.石灰石 b.生石灰 c.6 mol/L盐酸 d.稀硫酸 e.浓氨水
f.饱和氯化钠溶液。

①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④检验D出口处是否有氨气逸出的方法是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:

①在操作II中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作III的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
 (2010?绵阳模拟)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体.该反应原理可以用以下化学方程式表示,此反应是放热反应.NH3+CO2+H2O+NaCl (饱和)═NaHCO3(晶体)+NH4Cl
(2010?绵阳模拟)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体.该反应原理可以用以下化学方程式表示,此反应是放热反应.NH3+CO2+H2O+NaCl (饱和)═NaHCO3(晶体)+NH4Cl
| 42n |
| 25w |
| 42n |
| 25w |
工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O==NH4HCO3,NH4HCO3+NaCl(饱和)==NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟实验这一过程,获得碳酸钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器旁自左至右分别用A、B、C……符号标明(请见题后说明)

(1)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
A:__________________,B:___________________,C:__________________,
D:__________________,E_____________________。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶?

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com