
题目列表(包括答案和解析)


某化学课外活动小组在实验室做了如下一系列实验:
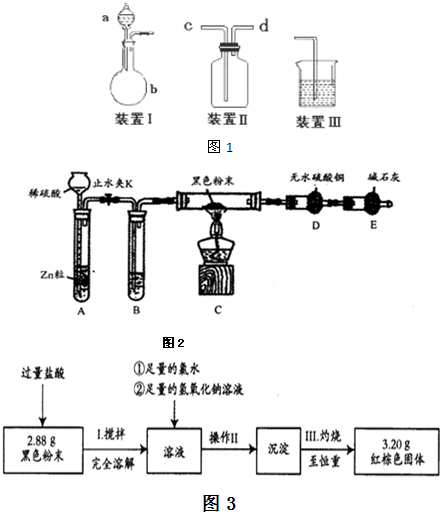
(1)该小组设计了如图所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能
 性。
性。
① 甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加
入 或 ,装置Ⅱ从 管口进气即可作为O2的收集装置。
 ② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
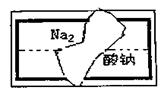
(2)小组在整理实验室的化学试剂时,发现一盛有
无色溶液的试剂瓶。标签破损(如图),请你根
据已掌握的知识,对该试剂可能是什么物质的溶
液作出二种猜想,并设计实验验证,写出任一种
的实验操作、现象和结论。
| 猜想物质的化学式 | 检验所需要的试剂 | 操作、现象和结论 | |
| ① | |||
| ② |
|
(3)该小组从ZnSO4、FeCl3的混合溶液中制取ZnSO4?7H2O过程如下:
a.在混合液中加入6 mol?L―1NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol?L―1的硫酸,保持溶液的pH在4~6,加热煮沸,
趁热过滤,滤液即为ZnSO4溶液
d.滤液中注入2 mol?L―1的硫酸,使其pH保持为2……
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列
问题:
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
① 步骤a中用pH试纸控制溶液pH=8,使用pH试纸的操作是 ;步骤b中如何
检验沉淀已经洗涤干净? 。
② 要制得ZnSO4?7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐
仪器是 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com