
题目列表(包括答案和解析)
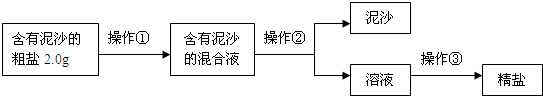
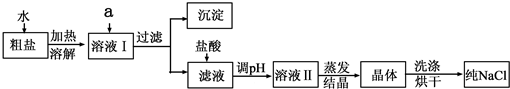
9、现有甲、乙、丙、丁四种物质的无色溶液,已知乙与丙的溶液混合生成的沉淀不溶于甲的溶液,乙与丁的溶液混合生成的沉淀可溶于甲的溶液.则下列各组物质中符合此现象的是( )
|
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解的质量/g | 36 | 109 | 21.5 | 9.6 |
| 实验 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| Ⅰ | 取样于试管中,向其中滴加无色酚酞溶液 | 无色溶液变红色 | 该溶液不可能是 NaCl NaCl 溶液,理由是NaCl溶液呈中性,不能使酚酞试液变色 NaCl溶液呈中性,不能使酚酞试液变色 |
| Ⅱ | 另取样于另一支试管中,向其中滴加足量的 稀盐酸(或稀硫酸) 稀盐酸(或稀硫酸) |
产生大量的气泡 | 该溶液为碳酸钠,有关反应的化学方程式为 Na2CO3+2HCl══2NaCl+H2O+CO2↑ Na2CO3+2HCl══2NaCl+H2O+CO2↑ |
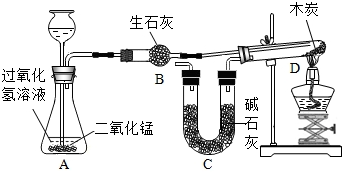

| 加热 |
| 加热 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com