(2012?东城区二模)SO
2随意排放会造成严重的大气污染.下列是某小组同学设计处理烟气(主要含SO
2、N
2、O
2、粉尘)中SO
2的方法.
(1)方法一:利用氯碱工业产品处理含SO
2的烟气,流程如下:
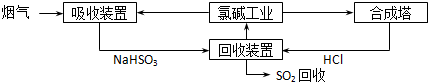
①“吸收装置”中发生反应的离子方程式是
SO2+OH-=HSO3-
SO2+OH-=HSO3-
;
②合成塔中每合成1mol 气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式是
H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1
H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1
;
③上述流程中循环利用的物质是
NaCl溶液
NaCl溶液
.
(2)方法二:利用FeCl
3溶液的氧化性吸收烟气中的SO
2.
①该反应的离子方程式是
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(反应a).为验证该反应,同学们将SO
2通入0.05mol?L
-1 FeCl
3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色.关于红褐色液体,以下是同学们的分析推测与实验.
| 分析推测 |
实验步骤 |
甲:生成了Fe(OH)3胶体
乙:经查阅资料,可能发生反应:
Fe3++6SO2
Fe(SO2)(反应b) |
ⅰ.制备Fe(OH)3胶体并检验
ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
②利用胶体的
丁达尔效应
丁达尔效应
(填性质)可以检验步骤ⅰ中是否得到了Fe(OH)
3胶体;
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是
加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动
加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动
(用离子方程式及必要的文字说明);
④经讨论后得出结论:FeCl
3溶液和SO
2反应过程中,反应a、b在体系中共存.请从化学反应速率和反应限度的角度分析,SO
2通入FeCl
3溶液中产生上述现象的原因是
由于化学反应速率:b>a,化学反应限度:a>b,所以产生上述现象
由于化学反应速率:b>a,化学反应限度:a>b,所以产生上述现象
.


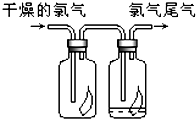 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是