
题目列表(包括答案和解析)
|
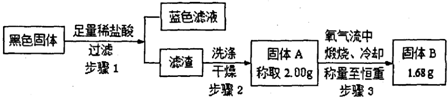
某研究性学习小组设计如下实验方案测定氧化钠中过氧化钠的含量.实验步骤如下:①取一定质量的样品放入烧杯中,加入足量稀硫酸,搅拌使之充分反应;②将反应后的溶液倒入蒸发皿中蒸发至恒重,冷却、称重.若在蒸发过程中,由于局部温度过高,造成液滴飞溅,则实验结果会 | |
| [ ] | |
A. |
偏低 |
B. |
偏高 |
C. |
无影响 |
D. |
无法判断 |
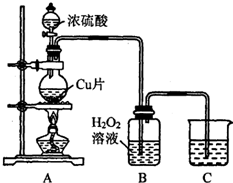

【实验探究】
(1)探究浓硝酸的强氧化性
将过量铜片置于具支试管的底部,通过分液漏斗往具支试管中加入少量浓硝酸,用排水法收集产生的气体。
①在具支试管中观察到实验现象是__________________________________。
②具支试管中发生反应的化学方程式为:____________________________。
(2)探究稀硝酸的强氧化性
①上述反应完成后,欲进一步探究稀硝酸的强氧化性,紧接着简便、合理的实验操作是:
________________________________________________________。
②能证明稀硝酸与铜反应的还原产物为NO的实验现象是______________(填标号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
【实验反思】
(1)某同学提出,实验过程中若操作不慎,易出现倒吸现象。对该实验装置进行改进的方案是:可在b与c之间连接____________________________(填装置的名称)。
(2)利用该装置先进行铜与浓硝酸的反应,再进行铜与稀硝酸反应的实验顺序的合理性是:
_____________________________________________________________________。
【问题讨论】
在用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)分别反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。针对此现象,同学们进行讨论,提出两种意见:
①认为两溶液所显颜色不同的原因,是因为Cu2+浓度的差异引起的。
②认为前者溶液呈绿色是因为生成的红棕色NO2气体溶解于溶液中引起的。
你认为上述意见______________(填“①”或“②”)合理。(注:若选填①,下题中只答Ⅰ;若选填②,下题中只答Ⅱ)Ⅰ.如果你认为合理,理由是____________________________。
Ⅱ.如果你认为合理,请设计一个简单的实验进行验证:____________________________。
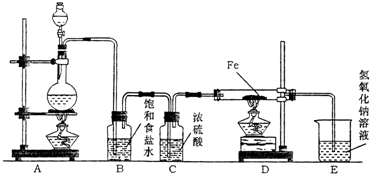 某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.
某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com