
题目列表(包括答案和解析)
| 难溶电解质 | CaCO3 | CaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 6.8×10-6 | 1.8×10-11 |
(8分)已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s)  mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m×[c(Am-)]n 称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
| 难溶电解质 | CaCO3 | CaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 6.8×10-6 | 1.8×10-12 |
(8分)已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s) 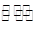 mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m×[c(Am-)]n 称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
|
难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-12 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________________________________________________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越 (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:______________________________________。
(3)设计第③步的目的是___________________________________________________。
(4)请补充第④步操作及发生的现象: _____。
已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s) mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=c(Mn+)m·c(Am-)n,称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
|
难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-11 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol ·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④______________________________________________________________________。
(1)由题中信息Ksp越大,表示电解质的溶解度越________(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:_____________________________。
(3)设计第③步的目的是________________________________________。
(4)请补充第④步操作及发生的现象:_________________________________。

 mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq) 性,查得如下资料:(25 ℃)
性,查得如下资料:(25 ℃)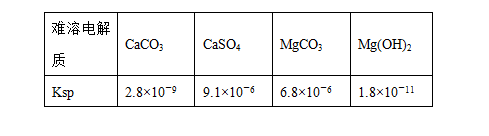
 液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com