
题目列表(包括答案和解析)
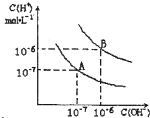 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: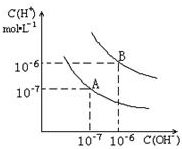 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: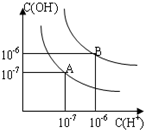 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: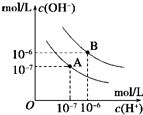 已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的( )
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的( )| A、A曲线代表25℃时水的电离平衡曲线 | B、当95℃时,pH=6的溶液呈中性 | C、25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4溶液混合,所得溶液的pH=7 | D、95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸 |

(1)则
② 。
(2)
(3)
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因: ⑤ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com