
题目列表(包括答案和解析)
(10分)一定的温度下向2L密闭容器中通入2molSO2和2molO2,发生反
应: 2SO2+O2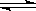 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1) 反应5min内,v(O2)=_________mol.L-1.min-1.
(2) 化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3) 判断该反应达到平衡的标志是_______________;
A.v消耗(SO2)=v生成(SO3) B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变 D.容器中气体的总物质的量不再变化
下列表格中的各种情况,可以用右图的曲线表示的是
| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中 2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, N2 + 3H2 | 氨气的浓度 | 活性高的 催化剂 | 活性一般的催化剂 |
| D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
 2SO3在不同条件下进行时SO2的转化率:
2SO3在不同条件下进行时SO2的转化率:| 温度\压强 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
 2SO3,2min时,测得O2的物质的量为1.6mol,则:
2SO3,2min时,测得O2的物质的量为1.6mol,则: 2SO3(g)△H=-2.5QkJ?mol-1
2SO3(g)△H=-2.5QkJ?mol-1 2SO3(g)△H=-2.5QkJ?mol-1
2SO3(g)△H=-2.5QkJ?mol-1 2SO3,下列说法错误的是( )
2SO3,下列说法错误的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com