
题目列表(包括答案和解析)
实验探究:
通过实验事实的验证与讨论,认识苯的结构式.提出问题:苯分子结构是碳碳单双键交替的结构吗?
(1)提出假设:从苯的分子式看,C6H6具有不饱和性;从苯的凯库勒结构式看,分子中含有碳碳双键,所以,苯一定能使________褪色;
(2)实验验证:
①苯不能使________褪色;
②经科学测定,苯分子里6个碳原子之间的键________(填“相同”或“不同”);6个碳原子和6个氢原子都在同一________上;
(3)结构:苯的凯库勒结构式中的双键跟烯烃的双键________(填“相同”或“不同”);苯的性质没有表现出不饱和性,结构稳定,说明苯分子________(填“有”或“没有”)一般的碳碳单、双键交替的环状结构.
(4)应用:为了表示苯分子的结构特点,结构简式用________表示,而凯库勒式表示苯分子结构是不确切的.
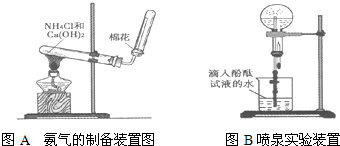
| 选项 | 气体 | 液体 |
| A | NO2 | H2O |
| B | Cl2 | 饱和食盐水 |
| C | CO2 | NaOH溶液 |
| D | CO | Na2CO3溶液 |
| E | SO2 | NaOH溶液 |

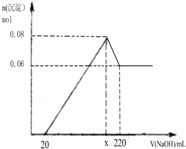
| 7m1 |
| 30 |
| 7m1 |
| 30 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com