
题目列表(包括答案和解析)
在一定温度和压强下,下列各可逆反应达到化学平衡
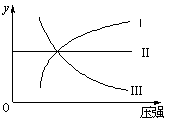 状态,各反应有如图所示的对应关系:
状态,各反应有如图所示的对应关系:
(1)N2(g)+3H2(g)![]() 2NH3(g) △H<0(曲线Ⅰ)
2NH3(g) △H<0(曲线Ⅰ)
(2)H2(g)+I2(g)![]() 2HI(g) △H>0(曲线Ⅱ)
2HI(g) △H>0(曲线Ⅱ)
(3)2SO3(g)![]() 2SO2(g)+O2(g) △H>0(曲线Ⅲ)
2SO2(g)+O2(g) △H>0(曲线Ⅲ)
则图像中y轴可以表示 ( )
①平衡混合气中一种生成物的体积分数 ②平衡混合气中一种反应物的体积分数 ③平衡混合气中一种生成物的产率 ④平衡混合气中一种反应物的转化率
A.①②③ B.①②④ C.①③④ D.②③④
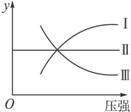
(1)N2(g)+3H2(g)![]() 2NH3(g);ΔH<0(曲线Ⅰ)
2NH3(g);ΔH<0(曲线Ⅰ)
(2)H2(g)+I2(g)![]() 2HI(g);ΔH>0(曲线Ⅱ)
2HI(g);ΔH>0(曲线Ⅱ)
(3)2SO3(g)![]() 2SO2(g)+O2(g);ΔH>0(曲线Ⅲ)
2SO2(g)+O2(g);ΔH>0(曲线Ⅲ)
则图象中y轴可以表示
①平衡混合气中一种生成物的体积分数 ②平衡混合气中一种反应物的体积分数 ③平衡混合气中一种生成物的产率 ④平衡混合气中一种反应物的转化率
A.①②③ B.①②④ C.①③④ D.②③④

 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是| c2(NH3) |
| c(N2).c3(H2) |
| c2(NH3) |
| c(N2).c3(H2) |
 (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:

| ||
| ||
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com