Ⅰ.在一定条件下,二氧化硫和氧气发生如下反应:2SO
2(g)+O
2 (g)

2SO
3(g)△H<0

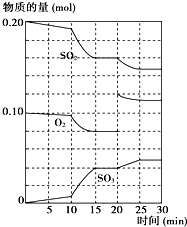
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO
2、O
2、SO
3物质的量变化如图,反应处于平衡状态的时间是
15~20min和25~30min
15~20min和25~30min
.
(2)据图判断,反应进行至20min时,曲线发生变化的原因是
增加了O2的量
增加了O2的量
(用文字表达);10min到15min的曲线变化的原因可能是
AB
AB
(填写编号).
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO
3的物质的量
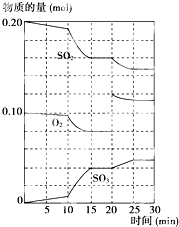
(3)下列是某研究机构的研究成果.硫酸工业的原料气是二氧化硫、氧气及大量的氮气,根据下列两幅图表,解读正确的选项是
AB
AB
(填写字母序号)

A.SO
2浓度高大,生产工艺复杂,生产成本反而会增加
B.生成规模大,气体用量多,生产成本就越低
C.SO
2转化率越大,生产成本越低
D.适量加入催化剂,可大大提高SO
2的转化率
Ⅱ.水煤气 (主要成分:CO、H
2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得.己知:
C(s)+H
2O(g)?CO(g)+H
2 (g)△H=+131.3kJ?mol
-1C(s)+
O
2(g)=CO(g)△H=-110.5kJ?mol
-1CO(g)+
O
2(g)=CO
2(g)△H=-283.0kJ?mol
-1H
2 (g)+
O
2 (g)=H
2O(g)△H=-241.8kJ?mol
-1H
2 (g)+
O
2 (g)=H
2O(l)△H=-285.8kJ?mol
-1(1)由CO、H
2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5kJ/mol,试写出由CO、H
2生成甲醇的热化学方程式
CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ?mol-1
CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ?mol-1
.
(2)甲醇-NaOH溶液-空气燃料电池已广泛的应用,试写出其负极的电极反应式
CH3OH-6e+8OH-=CO32-+6H2O
CH3OH-6e+8OH-=CO32-+6H2O
.

 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)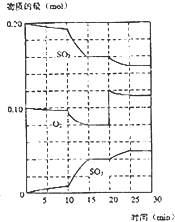 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0 2SO3(g)△H<0
2SO3(g)△H<0

 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0