
题目列表(包括答案和解析)
下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体。
|
单质 |
a |
b |
c |
d |
e |
|
沸点(℃) |
58.8 |
882.9 |
444.7 |
2 355 |
1 107 |
(1) a的元素在元素周期表中的位置为________。
(2) 写出d的元素原子的电子式________;其最高价氧化物形成的晶体为________晶体(填类型),溶于强碱的离子方程式为________________________________________。
(3) c与氢形成的分子X的空间构型为________;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式___________________________________。
(4) 上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式),e元素与N元素形成化合物的电子式为____________________________。
(5) b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是________。
下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体。
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(1) a的元素在元素周期表中的位置为________。
(2) 写出d的元素原子的电子式________;其最高价氧化物形成的晶体为________晶体(填类型),溶于强碱的离子方程式为________________________________________。
(3) c与氢形成的分子X的空间构型为________;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式___________________________________。
(4) 上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式),e元素与N元素形成化合物的电子式为___________________________________。
(5) b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是________。

| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | F | Na | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 代表氢原子代表
代表氢原子代表  碳原子),
碳原子),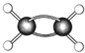 该有机物中碳元素与氢元素的质量比m(C):m(H)=
该有机物中碳元素与氢元素的质量比m(C):m(H)=
| ||
| ||
| 周期 主族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com