
题目列表(包括答案和解析)

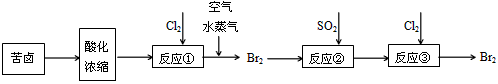
溴酸钾(KBrO3)为白色晶体,是一种常用的氧化剂和分析试剂,加热到370℃分解为溴化钾和氧气。用氯气生产溴酸钾的工艺流程如下:

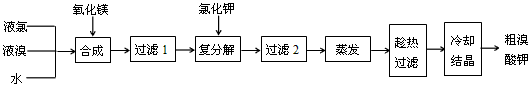
(1)“合成”过程所发生的反应中,氧化剂是___________,还原剂是___________。反应的化学方程式为______________________________________________________。
(2)“复分解”过程中反应的化学方程式为_______________________________。
(3)上述流程中第二次过滤的滤渣主要成分是________________。
(4)“趁热过滤”过程中“趁热”的原因是_________________________________________。
(5)溴酸钾具有毒性,食用少量即可引起呕吐和肾脏的损伤。然而美、日等国都允许在油炸薯片中添加一定量溴酸钾,以改善薯片的口感。我国也曾允许用作烘焙面包的添加剂,但已于2005年7月开始全面禁止在食品中使用溴酸钾。2007年,一批来自美国的油炸薯片在珠海口岸被我国有关部门检出含有溴酸钾而被禁止入境。从化学原理分析推测,有关国家认为在油炸薯片中添加溴酸钾是“安全”的理由是(用化学方程式表示)___________________
___________________________,而我国认为不安全的理由是_________________________
______________________________________。
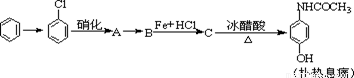
(8分)已知:①卤代烃在一定条件下能水解,如 (R为烃基,X表示卤原子)②有机物中的硝基在铁和盐酸作用下,能被还原成氨基:对乙酰胺基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低。扑热息痛的生产流程为:
(R为烃基,X表示卤原子)②有机物中的硝基在铁和盐酸作用下,能被还原成氨基:对乙酰胺基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低。扑热息痛的生产流程为:
请回答下列问题:
(1)写出反应的化学方程式
由氯苯制A:___________ _____
由A制B:__________ ________
由B制C:_____ _____________
(2)扑热息痛在潮湿环境中长期受热发生水解,写出扑热息痛水解的化学方程式。
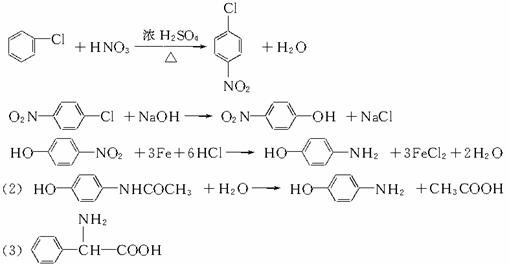
R-NO2+3Fe+6HCl→R-NH2+3FeCl2+2H2O对乙酰胺基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低。扑热息痛的生产流程为:
请完成下列问题:
(1)写出反应的化学方程式:
由氯苯制A:_____________________________________________;
由A制B:_____________________________________________;
由B制C:_____________________________________________。
(2)扑热息痛在潮湿环境中长期受热能发生水解,写出其水解的化学方程式:
____________________________________________________________________。
(3)写出与扑热息痛互为同分异构体、分子中含有苯环的氨基酸的结构简式:
____________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com