
题目列表(包括答案和解析)
Cu2S可与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO和NO2的物质的量比为1:1时,实际参加反应的Cu2S与实际被还原的HNO3的物质的量之比为 ( )
A.1:7 B.1:9 C.1:5 D.2:9
已知Cu2S与一定浓度的HNO3可发生以下反应: 3Cu2S+26HNO3=3CuSO4+3Cu(NO3)2+15NO2↑+5 NO↑+13H2O 下列说法正确的是( )
A、Cu2S既是还原剂,又是氧化剂 B、3mol Cu2S发生反应,有24mol电子转移
C、产物中只有CuSO4是氧化产物 D、参加反应的HNO3中有10/13氧化剂
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图。
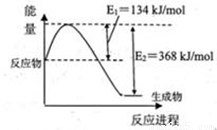
已知:① N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
则在298k时,反应:2NO(g)+2CO(g)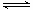 N2(g)+2CO2(g)的△H=
。
N2(g)+2CO2(g)的△H=
。
(2)将0.20mol NO2和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
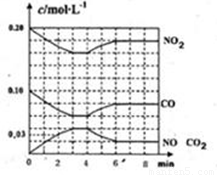
①下列说法正确的是 。(填序号)
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应反应速率增大
②计算产物NO在0~2min时平均反应速率v(NO)= mol·L-1·min-1;
③第4min时改变的反应条件为 (填“升温”、“降温”);
④计算反应在第6min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060mol,平衡将 移动(填“正向”、“逆向”或“不”)。
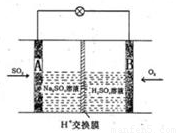
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25molSO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSP=2.8×10-9mol2/L2。现将2×10-4mol/L的Na2CO3溶液与一定浓度的CaC12溶液等体积混合生成沉淀,计算应加入CaC12溶液的最小浓度为 。
|
已知Cu2S与一定浓度的HNO3可发生以下反应: 3Cu2S+26HNO3 下列说法正确的是 | |
| [ ] | |
A. |
Cu2S既是氧化剂,又是还原剂 |
B. |
3 mol Cu2S发生反应,有24 mol电子转移 |
C. |
产物中只有CuSO4是氧化产物 |
D. |
参加反应的HNO3中有 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com