
题目列表(包括答案和解析)
| 15cV×10-3 | a |
A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。
请回答下列问题:
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是________。
(2)A和C按原子个数比1:l形成4原子分子Y.Y的结构式是________。
(3)分子X的电子式是_____________;D可以在液态X中发生类似于与A2C的反应,
写出反应的化学方程式_________________________________ 。
(4)实验证明,熔融的EF3不导电,其原因是__________________________。
(5)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
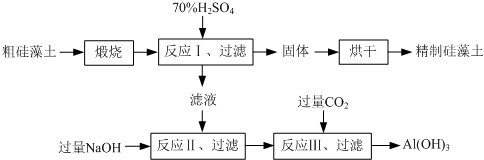
(6)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH_________________(“增大”、“减小”或”不变”)。
③除去杂质后的Z溶液从液体出口___________________(填写“A”或“B”)导出。
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
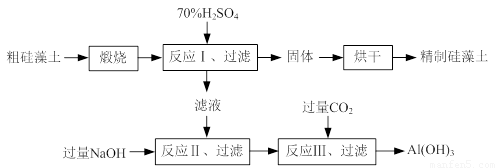
(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液V mL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤4中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为
。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为
。
(10分)铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ________________ 。
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
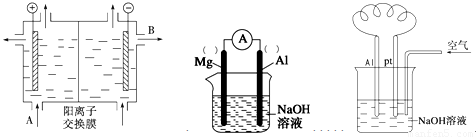
①请写出A、B两处物质的名称:A___________________、B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。?
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(要求用单线桥标出电子转移的方向和数目)
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为 ______________________ ;
正极的电极反应式为___________________________________。
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
 ⑴粗硅藻土高温煅烧的目的是 。
⑴粗硅藻土高温煅烧的目的是 。
⑵反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
⑶实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤5中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com