
题目列表(包括答案和解析)


请回答下列问题:
①物质甲是________(填字母序号)。
a. NH3·H2O b. CuCO3 c. NaOH d. CuO
②该方案中调节pH的范围是________
第二组:过氧化氢氧化法
将铜丝放到稀硫酸中,加入10%的H2O2,微热。充分反应后,经过滤、蒸发结晶、抽滤等操作,用少量
95%的酒精淋洗后晾干,得到硫酸铜晶体。 请回答下列问题:
③加热时温度不宜过高的原因是______________,晶体采用酒精淋洗的优点是______________
硫酸铜是一种用途广泛的化工原料.将适量稀硝酸分多次加人到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示).

(1)图中烧瓶内发生的离子反应方程式为:________.
(2)反应时B瓶内的现象是________________.
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把Fe2(SO4)3作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应.反应完全后向其中加人物质甲调节pH,产生Fe(OH)3沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用.
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
请回答下列问题:
①物质甲是________(填字母序号).
a.NH3·H2O
b.CuCO3 c.NaOH d.CuO②该方案中调节
PH的范围是________.第二组:过氧化氢氧化法
将铜丝放到稀硫酸中,加入10%的H2O2,微热.充分反应后,经过滤、蒸发结晶、抽滤等操作,用少量95%的酒精淋洗后晾干,得到硫酸铜晶体.

请回答下列问题:
③加热时温度不宜过高的原因是________________,晶体采用酒精淋洗的优点是________________.
硫化物通常有“废物”之称。硫化物据其溶解性可以分三类: ① 易溶于水的有 K2S 、Na2S 、(NH4)2S 等; ② 易溶于非氧化性强酸、不溶于水的有 FeS 、 ZnS ; ③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如 HgS 、 Ag2S 、 CuS 、 Cu2S 。其中,Ag2S、 CuS 、 Cu2S 能溶于硝酸发生氧化还原反应,而 HgS只能溶于王水(硝酸与盐酸的混合液)。氢硫酸溶液中存在下列平衡:
H2S ![]() H ++ HS-, HS-
H ++ HS-, HS- ![]() H + + S2-。
H + + S2-。
(1)K2S溶液显___________性,原因______________________(用离子方程式表示)
K2S溶液中离子浓度由大到小顺序____________________________________________
(2)推测将硫化氢通入硫酸铜溶液中生成硫酸的原因是___________________________
(3)在氢硫酸溶液中改变下列条件,使溶液中。c(OH-)、c(S2-)都增大的是______
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(4)已知在常温下 FeS 的Ksp=6.25 ×10-18,H2S饱和溶液中c(H+)与c S2-)之间存在如下关系:c2(H+)·(S2-)= 1.0×10-22 。在该温度下,将适量FeS 入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________ 。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_______、_______。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。

请回答下列问题:
①能用作干燥氨气的装置有_____________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有____________ (填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有___________(填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有____________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是____________。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。
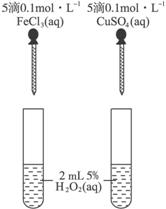
①可通过观察__________________________________________来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是_____________________________
_____________________________________________________________________;
若不采用A同学的改进方案,你认为还可以如何改进?
____________________________________________________________________
___________________________________________________________________
____________________________________________________________________。
浓硫酸具有以下A~F的性质:A酸性;B高沸点难挥发;C吸水性;D脱水性;E强氧化性;F溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为 。实验中往往有大量蓝色固体析出,可见浓硫酸在该实验中表现的性质有 。(浓硫酸性质用“A”、“B”、“C”、“D”、“E”、“F”填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为 。硫酸在该反应中表现的性质是 。
(3)在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式: 。与(2)中反应比较,反应条件不同的原因是 。
(4)向蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味的气体产生。写出产生有刺激气味气体的化学方程式: 。该实验中浓硫酸表现的性质有 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com