
题目列表(包括答案和解析)
25℃时,氢氧化钠的溶解度为40 g.向100 g 水中投入一定量金属钠,反应完全后,恢复至25℃,此时溶液恰好处于饱和状态且无任何晶体析出,则投入的钠的质量约为
A.23.5 g B.11.5 g C.23.0 g D.19.5 g
25℃时,氢氧化钠的溶解度为40 g,向100 g 水中投入一定量金属钠,反应完全后,恢复至25℃,此时溶液恰好处于饱和状态且无晶体析出,则投入的钠的质量约为( )
A.23.5 g ![]() 11.5 g C.19.5 g D. 23.0 g
11.5 g C.19.5 g D. 23.0 g
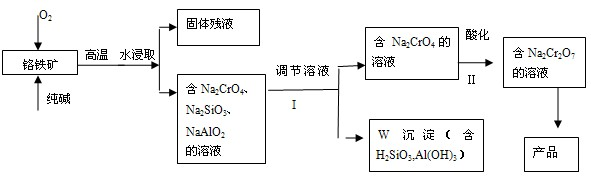
| c(Cr2O72-) |
| c2(CrO42-)?c2(H+) |
| c(Cr2O72-) |
| c2(CrO42-)?c2(H+) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com