
题目列表(包括答案和解析)
要熟练掌握有机化学基础知识。按要求回答下列问题
(1)测得某烃与乙烯的混合气体的平均相对分子质量为20,则该烃为_______。
(2)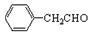 的不饱和度为____________。
的不饱和度为____________。
(3)相同质量的乙烷、乙烯、乙炔完全燃烧,消耗氧气物质的量最多的物质是_____。
(4)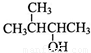 的系统命名为__________________。
的系统命名为__________________。
 某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:
某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:

(1)[实验一]所用试剂:甲___________、乙___________、丙___________。
丙中现象______________________________________________________________。
实验结论______________________________________________________________。
(2)[实验二]所用试剂:甲___________、乙___________、丙___________。
丙中现象_____________________________________________________________。
实验结论______________________________________________________________。
已知物质A、B、C、D、E、F有如下转化关系:
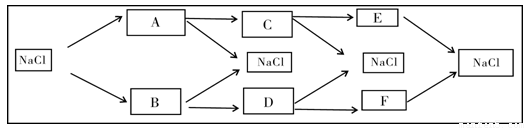
试根据上述变化,按要求写出两组C、D、E、F的可能化学式。
要求①C必须为不同的物质;②A、B、C、E的各元素原子序数不超过20;
|
|
C |
D |
E |
F |
|
第一组 |
|
|
|
|
|
第二组 |
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com