
题目列表(包括答案和解析)
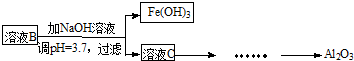 硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如下方案,分离样品中各种金属元素.请回答下列问题.
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如下方案,分离样品中各种金属元素.请回答下列问题.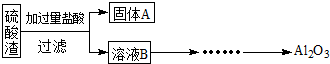
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为 L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用NaOH溶液的物质的量浓度。(写出计算过程)
实验 | 序号样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测,1.81 g样品进行同样实验时,生成氨气的体积(标况)为________ L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
(3)求所有NaOH溶液的物质的量浓度为___________ mol·L-1。
硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:①二氧化硫的制取和净化;②二氧化硫转化为三氧化硫;③三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用NaOH溶液的物质的量浓度。(写出计算过程)
硫酸工业生产应考虑综合经济效益问题。
⑴若1g含SiO2和FeS2的某硫铁矿样品,在氧气中充分燃烧,残余固体质量为0.84g。某硫酸厂每天用这种矿石500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%,则每天可以制得98%的H2SO4质量为 t。
⑵某硫酸厂以硫为原料每天生产98%的H2SO4 a t。若送风(鼓入空气)后使硫充分燃烧,并在下一步催化氧化时不再补充空气,设送风机每天输送空气的体积为b m3/台(标准状况)。求理论上至少应安装 台送风机(空气中氧气的体积分数为21%)。
⑶硫酸工业的尾气通常是转化为硫酸铵的。若尾气中SO2、O2的体积分数分别为0.4%和0.5%。向尾气中通入空气(设空气中O2的体积分数为20.5%,且不含SO2),在400℃、催化剂作用下反应,再与NH3混合,同时喷水降温至200℃,在热的结晶装置中得到(NH4)2SO4晶体。若某硫酸厂每天排放出的尾气为5×105m3(标准状况),按上述方法该厂每月(以30天计)最多能获得 吨硫酸铵?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com