
题目列表(包括答案和解析)
A.氯化铵溶液呈酸性![]()
![]() NH3+ H+
NH3+ H+
B.氢硫酸的电离H2S![]() 2 H++S2-
2 H++S2-
C.向小苏打溶液中加入醋酸溶液![]() +H+====CO2+H2O
+H+====CO2+H2O
D.在标准状况下,向10 mL 0.1 m01.L-1 FeBr2溶液中通入22.4 mLCl2
2Fe2++2Br-+2Cl2====2Fe3++Br2+4Cl-
向10 mL 0.1 mol·L-1的CuSO4溶液中加入10 mL 0.15 mol·L-1的NaOH溶液时,产生一种蓝色沉淀。经测定溶液中的Cu2+已几乎沉淀完全。则该沉淀的主要成分是 ( )
| A.Cu(OH)2 | B.Cu2(OH)2SO4 |
| C.3Cu(OH)2·CuSO4 | D.Cu(OH)2·3CuSO4 |
A.氯化铵溶液呈酸性 NH![]()
![]() NH3+H+?
NH3+H+?
B.氢硫酸电离 H2S![]() 2H++S2-??
2H++S2-??
C.向小苏打溶液中加入醋酸溶液 HCO![]() +H+
+H+![]() CO2+H2O?
CO2+H2O?
D.在标准状况下,向10 mL 0.1 mol·L-1 FeBr2溶液中通入22.4 mL Cl2 2Fe2++2Br-+2Cl2![]() 2Fe3++Br2+4Cl-?
2Fe3++Br2+4Cl-?
(16分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA-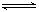 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积KW=c 2(OH-) 2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
 已知难溶物CaA在水中存在溶解平衡;CaA(s)
已知难溶物CaA在水中存在溶解平衡;CaA(s) 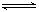 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是( )

A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-)
C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com