
题目列表(包括答案和解析)
(1)已知工业上生产H2的过程中有如下反应: CO
(g) + H2O (g) CO2(g)
+ H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g)
+ H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
|
浓度 物质 |
CO |
H2O |
CO2 |
H2 |
|
起始浓度/(mol·L-1) |
2.0 |
x |
0 |
0 |
|
平衡浓度/(mol·L-1) |
0.4 |
6.4 |
1.6 |
1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为 。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
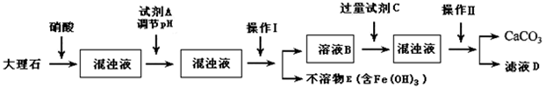
 ,溶液变红色,说明滤液中含Fe3+
,溶液变红色,说明滤液中含Fe3+ ,溶液变红色,说明滤液中含Fe3+
,溶液变红色,说明滤液中含Fe3+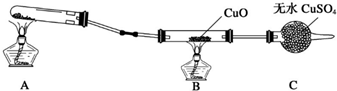
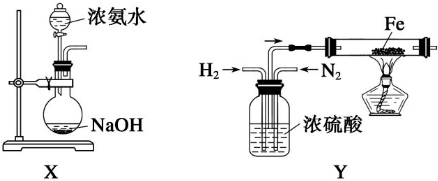
| ||
| ||
| ||

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com