
题目列表(包括答案和解析)
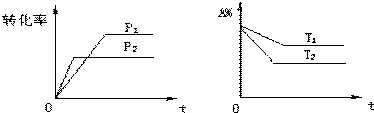
可逆反应aA(g)+bB(g) ![]() cC(g)+dD(g),根据图象判断,下列叙述正确的是
cC(g)+dD(g),根据图象判断,下列叙述正确的是
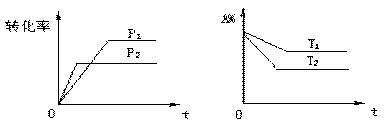
A、p1<p2,a+b<c+d,T1<T2, 正向吸热 B、p1<p2,a+b>c+d,T1>T2, 正向吸热
C. p1<p2,a+b<c+d,T1>T2, 正向吸热 D. 以上答案均不对
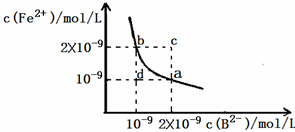 已知H2B为二元弱酸,请回答下列问题:
已知H2B为二元弱酸,请回答下列问题:| 溶解 |
| 溶解 |
 已知某工业废水中含有N
已知某工业废水中含有N| O | - 3 |
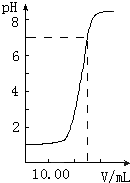 如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com