
题目列表(包括答案和解析)
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。
8Cu+4FeO+2Fe2O3+16SO2。
(1)上述冶炼过程产生大量SO2。下列处理方案中合理的是_________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(2)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:![]() +2I-====
+2I-====![]() +I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程:_____________、____________。(不必配平)
+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程:_____________、____________。(不必配平)
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是____________________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为____________________________________________________________。
证明炉渣中含有FeO的实验现象为________________________________________。
(14分)黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)、若冶炼铜的反应为:8 CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
CuFeS2中Fe的化合价为+2,反应中被氧化的元素是___________(填元素符号)。
(2)、上述冶炼过程中产生大量SO2,下列处理方案合理的是___________(填代号)。
a.高空排放 b.用于制备硫酸
c.用浓硫酸吸收 d.用纯碱溶液吸收制Na2SO3
(3)、采用火法熔炼工艺生产铜的中间过程会发生Cu2O与Cu2S在高温下转化为Cu,放出SO2气体的反应。若Cu2O和Cu2S正好完全反应,Cu2O和Cu2S的物质的量之比为_____;Cu2S和HNO3有如下反应:3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO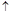 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
(4)、过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82-+2I—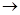 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一。其中炉渣的主要成分 是FeO、Fe2O3、SiO2、Al2O3。各物质有如下转化关系,请回答:

(1)写出能证明SO2具有氧化性且现象明显的化学方程式________________。
(2)用NaOH溶液吸收SO2所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量浓度由大到小的顺序是________。
(3)写出Cu2S熔炼制取粗铜的化学方程式________________________
(4)废电解液中常含有Pb2+、Zn2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,C(Zn2+): C(Pb2+)=________。[已知:Ksp(PbS)=3.4×10-28mol2·L-2、Ksp(ZnS)=1.6×10-24mol2·L-2)]
(5)写出证明溶液I中含有Fe2+的实验过程________________。
(6)Na2FeO4能杀菌净水的原因是________________。
(7)Na2FeO4和Zn可以组成碱性电池,其反应式为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)+4OH-。请写出放电时正极电极反应式________________。
(14分)黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)、若冶炼铜的反应为:8 CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
CuFeS2中Fe的化合价为+2,反应中被氧化的元素是___________(填元素符号)。
(2)、上述冶炼过程中产生大量SO2,下列处理方案合理的是___________(填代号)。
a.高空排放 b.用于制备硫酸
c.用浓硫酸吸收 d.用纯碱溶液吸收制Na2SO3
(3)、采用火法熔炼工艺生产铜的中间过程会发生Cu2O与Cu2S在高温下转化为Cu,放出SO2气体的反应。若Cu2O和Cu2S正好完全反应,Cu2O和Cu2S的物质的量之比为_____;Cu2S和HNO3有如下反应:3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
(4)、过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82-+2I— 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一。其中炉渣的主要成分 是FeO、Fe2O3、SiO2、Al2O3。各物质有如下转化关系,请回答:
(1)写出能证明SO2具有氧化性且现象明显的化学方程式________________。
(2)用NaOH溶液吸收SO2所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量浓度由大到小的顺序是________。
(3)写出Cu2S熔炼制取粗铜的化学方程式________________________
(4)废电解液中常含有Pb2+、Zn2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,C(Zn2+): C(Pb2+)=________。[已知:Ksp(PbS)=3.4×10-28mol2·L-2、Ksp(ZnS)=1.6×10-24mol2·L-2)]
(5)写出证明溶液I中含有Fe2+的实验过程________________。
(6)Na2FeO4能杀菌净水的原因是________________。
(7)Na2FeO4和Zn可以组成碱性电池,其反应式为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)+4OH-。请写出放电时正极电极反应式________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com