
题目列表(包括答案和解析)
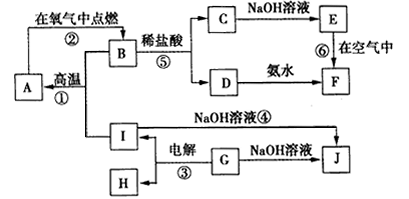
A~J分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态两性氧化物,A是一种金属单质,F是一种红褐色固体,A、B、C、D、E、F六种物质中均含同一种元素,请填写下列空白:
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中的位置是 。
(2)B的化学式: ,K的电子式: 。
(3)写出④的离子方程式: 。
(4)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH 7(填“>”、“<”或“=”),用离子方程式表示其原因: 。

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| CO | 2- 3 |
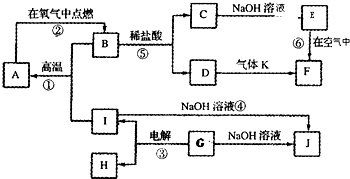
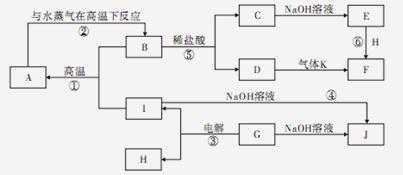
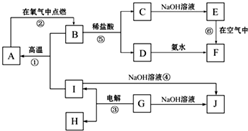 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com