
题目列表(包括答案和解析)
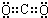
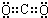


| 实验 | 主要实验步骤及实验现象 |
| 1 | 向Y溶液中加入稀H2SO4,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色. |
| 2 | 向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解. |
| 3 | 向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀. |


| 水解 |
| 水解 |
(14分)A、B、D、X、Y是由短周期元素组成的化合物,其中X、Y分别是常见的强酸、强碱。它们存在如下图转化(部分生成物和水略去)。
(1)若A、B均为气体,在水溶液中反应生成正盐D,其中A是形成酸雨的主要物质。则D的化学式是 。B发生催化氧化反应的化学方程式是 。
(2)若A、B、D含有相同的金属元素,则此元素在元素周期表中的位置是 ,工业上制取该金属单质的化学方程式为: ,现将X滴入B的溶液中至过量,该过程发生的离子方程式为: 。
(3)若A为无色无味的气体,B为盐,且A、B、D三种物质含有相同元素,则A的电子式为: ,A与B溶液反应生成D的离子方程式为: 。
平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物)。②Al3+在pH=5.0时沉淀完全; Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
I.向一定量的X粉末中加入45.0mL的2mol/L盐酸溶液中,恰好完全反应并收集到112mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。沉淀物进行洗涤干燥后重1.74g,
(1)A的电子式是 。
(2)由I可确定X中存在两种带负电荷的原子团及个数比
(3)由I判断X一定不含有的元素是 。
(4)Ⅲ中生成B的离子方程式是 。
(5)Ⅳ中B溶解的化学方程式是 。
(6)沉淀C的化学式是 。
(7)若X中n(B)∶n(C)=1∶3,则X的化学式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com