
题目列表(包括答案和解析)
| ||
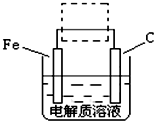 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH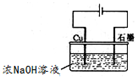 溶液的pH为
溶液的pH为(分)A、B、C、D、E、F六种元素(前20号元素)的核电荷数依次增大。C是地壳中含量最高的元素;D的最高价氧化物的水化物分别能与E、F的最高价氧化物的水化物反应;E原子的最外层电子数是其最内层电子数的3倍;F元素是化学肥料中一种重要元素,其原子的次外层电子数与倒数第三层的电子数相等;A与F具有相同的最外层电子数;B元素的某种单质常作为干电池中的电极材料。试回答下列问题:
(1)由A、B两元素按原子个数之比为1︰1组成的某分子,其相对分子质量小于30,请写出实验室制备该物质的化学反应方程式 。
(2)D、E、F三种元素的原子半径由大到小顺序是 (用元素符号表示)。
(3)由C、D、E、F四种元素组成的某盐,可用作净水剂,也可用于制作膨化食品。该盐的化为 ,将该盐溶液与Ba(OH)2溶液按溶质物质的量之比1:2混合反应,此反应的离子方程式为 。
A、B、C、D、E、F六种元素(前20号元素)的核电荷数依次增大。C是地壳中含量最高的元素;D的最高价氧化物的水化物分别能与E、F的最高价氧化物的水化物反应;E原子的最外层电子数是其最内层电子数的3倍;F元素是化学肥料中一种重要元素,其原子的次外层电子数与倒数第三层的电子数相等;A与F具有相同的最外层电子数;B元素的某种单质常作为干电池中的电极材料。试回答下列问题:
(1)由A、B两元素按原子个数之比为1︰1组成的某分子,其相对分子质量小于30,请写出实验室制备该物质的化学反应方程式 。
(2)D、E、F三种元素的原子半径由大到小顺序是 (用元素符号表示)。
(3)由C、D、E、F四种元素组成的某盐,可用作净水剂,也可用于制作膨化食品。该盐的化为 ,将该盐溶液与Ba(OH)2溶液按溶质物质的量之比1:2混合反应,此反应的离子方程式为 。
(1)由A、B两元素按原子个数之比为1:1组成的某分子,其相对分子质量小于30,请写出实验室制备该物质的化学反应方程式_____________________________________________.
(2)D、E、F三种元素的原子半径由大到小顺序是______________(用元素符号表示)。
(3)由C、D、E、F四种元素组成的某盐,可用作净水剂,也可用于制作膨化食品。该盐的化学式为___________,将该盐溶液与Ba(OH)2溶液按溶质物质的量之比1:2混合反应,此反应的离子方程式为_________________________________________________________。
 6SO2+Fe3O4,氧化产物为______,若有3mol FeS2参加反应,转移电子的物质的量为______.
6SO2+Fe3O4,氧化产物为______,若有3mol FeS2参加反应,转移电子的物质的量为______. 一起净水,其原理为______(用离子方程式表示).
一起净水,其原理为______(用离子方程式表示). 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为______(溶液体积变化忽略不计).
溶液的pH为______(溶液体积变化忽略不计).湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com