
题目列表(包括答案和解析)
氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损。一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2 → Si3N4+12HCl
氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂。
回答以下问题:
(1)氮原子的最外层电子排布式是_________________;氮元素有多种化合价,写出含2种价态氮的化合物的化学式_________________(举一例)。
(2)硅原子核外电子排布在______________种不同能量的电子亚层上,氮化硅属______________晶体。
(3)上述反应中,属于同一周期的元素符号有_________,用___________________________事实可以比较它们的非金属性强弱。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。NH3分子的空间构型是______________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是_________(举一例)。
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有_____mol,其中转移电子数目_____。
(6)肼能与硫酸反应生成N2H6SO4。该物质晶体类型与硫酸铵相同,则其溶液PH_______7(填>、<或=),原因是____________________(用离子方程式表示)
(15分)氮化硅是一种重要的结构陶瓷材料,硬度大、耐磨损。利用SiO2和C的混合粉末在N2的气氛中加热至1300℃反应制得。请回答下列问题:
(1)已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,则氮化硅的化学式____,晶体类型是 ;
(2)基态Si原子的电子排布式为_________;Si和C相比,电负性较大的是_________,
(3)在SiO2晶体结构中,O-Si-O的键角是_______,Si原子和周围的四个O原子组成的空间构型为 ,SiO2中Si的杂化类型_______;
(4)氮化硅抗腐蚀能力强,一般不与其他无机酸反应,但能和氢氟酸反应生成硅酸。试写出该反应的化学方程式 。
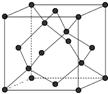
(5)晶体硅的晶胞如图所示,则每个晶体硅的晶胞中含有 个硅原子。
(15分)氮化硅是一种重要的结构陶瓷材料,硬度大、耐磨损。利用SiO2和C的混合粉末在N2的气氛中加热至1300℃反应制得。请回答下列问题:
(1)已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,则氮化硅的化学式____,晶体类型是 ;
(2)基态Si原子的电子排布式为_________;Si和C相比,电负性较大的是_________,
(3)在SiO2晶体结构中,O-Si-O的键角是_______,Si原子和周围的四个O原子组成的空间构型为 ,SiO2中Si的杂化类型_______;
(4)氮化硅抗腐蚀能力强,一般不与其他无机酸反应,但能和氢氟酸反应生成硅酸。试写出该反应的化学方程式 。
(5)晶体硅的晶胞如图所示,则每个晶体硅的晶胞中含有 个硅原子。
氮化钠(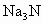 )是一种重要的化合物,它与水反应可产生
)是一种重要的化合物,它与水反应可产生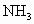 .请回答下列问题:
.请回答下列问题:
(1)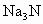 的电子式是________,该化合物是由________键形成.
的电子式是________,该化合物是由________键形成.
(2)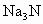 与盐酸反应生成________种盐,其电子式是________.
与盐酸反应生成________种盐,其电子式是________.
(3)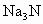 与水的反应属于________反应.
与水的反应属于________反应.
(4)比较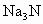 中两种微粒的半径:
中两种微粒的半径: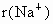 ________
________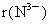 (填写“<”、“=”、“>”).
(填写“<”、“=”、“>”).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com