
题目列表(包括答案和解析)
19-I(6分)下列描述中正确的是
A.CS2为V形的极性分子
B.Cl0— 3 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO2— 3 的中心原子均为sp3杂化
19-Ⅱ(14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________._______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
 |

(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
(20分)
19-I下列描述中正确的是
A、CS2为V形的极性分子
B、Cl0— 3 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO2— 3 的中心原子均为sp3杂化
19-Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)Ni0晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;


(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是![]() 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
19-I(6分)下列描述中正确的是
A.CS2为V形的极性分子
B.Cl0— 3 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO2— 3 的中心原子均为sp3杂化
19-Ⅱ(14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________._______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
 |

(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是![]() 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
19-I(6分)下列化合物中,含有非极性共价键的离子化合物是
A.CaC2 B.N2H4
C.Na2S2 D.NH4NO3

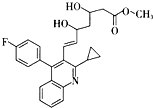 ,再转化为F.你认为合成路线中设计步骤②的目的是
,再转化为F.你认为合成路线中设计步骤②的目的是 ,该反应原理在有机合成中具有广泛应用.试写出以
,该反应原理在有机合成中具有广泛应用.试写出以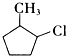 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH| 浓H2SO4 |
| 170℃ |
| H2 |
| 催化剂/△ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com