
题目列表(包括答案和解析)
(1)用m、V表示溶液物质的量浓度_________________。
(2)用w、ρ表示溶液物质的量浓度_________________。
(3)用c、ρ表示溶液的质量分数_________________。
(4)用w表示该温度下NaCl的溶解度________________。
(14分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。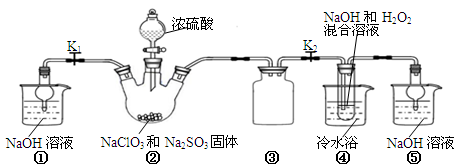
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6) 样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, |
样品含NaCl | |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, |
样品含NaOH |
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2?? (该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
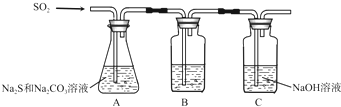
(1)吸硫装置如图所示。
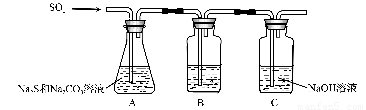
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ???????? ,表明SO2吸收效率低的实验现象是B中溶液 ????????? 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 ??????????????? 、?????????????? 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:IO3-+5I-+6H+== 3I2+3H2O???? 2S2O32-+I2==S4O62-+2I-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com