
题目列表(包括答案和解析)
| Mg | Al | MgO | Al2O3 | |
| 熔点/℃ | 648.8 | 660.4 | 2852 | 2072 |
| 沸点/℃ | 1107 | 2467 | 3600 | 2980 |
| 燃烧热*/kJ?mol-1 | 601.8 | 833.6 |
| Mg | Al | MgO | Al2O3 | |
| 熔点/℃ | 648.8 | 660.4 | 2852 | 2072 |
| 沸点/℃ | 1107 | 2467 | 3600 | 2980 |
| 燃烧热*/kJ?mol-1 | 601.8 | 833.6 |
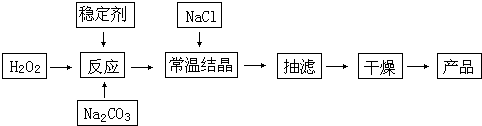
| ||
| ||
下列关于工业生产说法正确的是
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理
C.工业上用电解熔融氧化物的方法制金属镁和铝
D.氯碱工业中的阳离子交换膜阻止阳离子通过
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com