
题目列表(包括答案和解析)
已知有机物的分子式为 ,该有机物分子中C、H元素原子的个数比为________,则有机物的最简式为________.若已知某有机物分子式为
,该有机物分子中C、H元素原子的个数比为________,则有机物的最简式为________.若已知某有机物分子式为 ,有机物中C、H、O元素的质量比为________,物质的量之比为________,最简式为________,最简式的式量为________,分子式是最简式的________倍,通过上述计算明确有机物分子式和最简式的关系是________.
,有机物中C、H、O元素的质量比为________,物质的量之比为________,最简式为________,最简式的式量为________,分子式是最简式的________倍,通过上述计算明确有机物分子式和最简式的关系是________.
由乙烯合成有机物F(二乙酸乙二酯),采用下列合成路线:
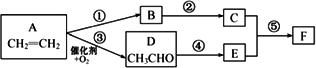
(1)已知有机物![]() 的名称为乙二酸二甲酯.请写出F的结构简式________.
的名称为乙二酸二甲酯.请写出F的结构简式________.
(2)在上述反应中属于取代反应的有________(填反应代号).
(3)A、D、E、F中能引入C中官能团的物质有________(填反应物代号),其反应⑤的化学方程式为________.
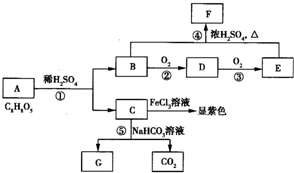 已知有机物A是光刻胶剥离液的主要成分之一,用于液晶显示器等,也可制高纯度医药制剂,F的最简式与D的分子式相同,有机物A中相同的官能团处于邻位,不同的官能团处于对位.有机物A~G之问的转化关系如图所示.
已知有机物A是光刻胶剥离液的主要成分之一,用于液晶显示器等,也可制高纯度医药制剂,F的最简式与D的分子式相同,有机物A中相同的官能团处于邻位,不同的官能团处于对位.有机物A~G之问的转化关系如图所示.





(10分)现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们。根据以上信息回答下列有关问题:
(1)写出C2A4的电子式 。C2A4和A2D2既具有氧化性,又具有还原性,从化合价的角度解释C2A4和A2D2既具有氧化性又具有还原性的原因
。
(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程:
 ,该化合物与CA3和A2D的熔点由高到低的顺序为 (用化学式表示)。
,该化合物与CA3和A2D的熔点由高到低的顺序为 (用化学式表示)。
(3)燃料电池是一种新型电池。由一种日常生活中最常见的有机物(分子式为B2A6D)与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视。写出负极的电极反应式: 。
(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃。CA3、A2D、EA3的热稳定性由强到弱的顺序为 (用化学式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com