
题目列表(包括答案和解析)
 现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |


| 读数次数 | 质量/g | |
锥形瓶十水十试样 |
第1次 | 196.4 |
| 第2次 | 196.2 | |
| 第3次 | 196.1 | |
| 第4次 | 196.0 | |
| 第5次 | 196.0 |

现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
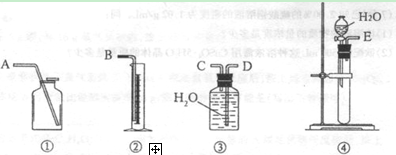
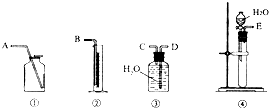
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
所选用装置的连接顺序为(填各接口的字母):
。
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g,并称量锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表。
|
|
读数次数 |
质量/g |
|
锥形瓶+水+试样 |
第1次 |
196.30 |
|
第2次 |
196.15 |
|
|
第3次 |
196.05 |
|
|
第4次 |
196.00 |
|
|
第5次 |
196.00 |
①计算CaC2的质量分数时,不必作第6次读数的原因是: 。
②此试样中CaC2的质量分数为 。(保留2位有效数字)
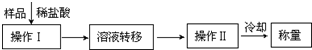
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下:
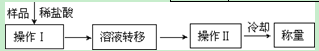
①操作Ⅱ的名称是 。
②在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com