
题目列表(包括答案和解析)
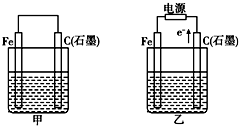 如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )
如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )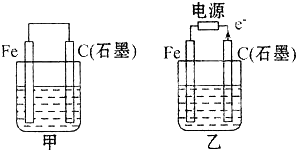
| ||
| ||
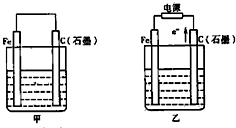 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.
| ||
| ||
| ||
| ||
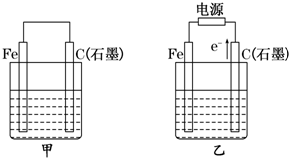 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.
| ||
| ||
Ⅰ已知在常温常压下:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)?? △H=_1275.6kJ?mol-1
②H2O(l)═H2O(g)?? △H=+44.0kJ?mol-1写出表示甲醇燃烧热的热化学方程式:??????????????? 。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 ???? 。
(2)判断 ⑴ 中可逆反应达到平衡状态的依据是(填序号) ??????????? 。
①v正(CH3OH) = 3v逆(H2) ? ②混合气体的密度不变 ③混合气体的平均相对分子质量不变?????? ④CH3OH、H2O、CO2、H2的浓度都不再发生变化???? ⑤CO2和H2的浓度之比为1:3
(3)图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。? 已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。

Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题:

(1)若两池中均盛放CuSO4溶液
①甲池中石墨棒上的电极反应式为____________________.
②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则其电解后的pH为????? (忽略溶液体积的变化)。
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com