
题目列表(包括答案和解析)
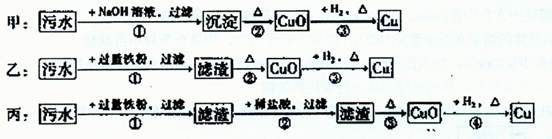
某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
下列判断正确的是 ( )
| A.甲方案中的反应涉及到置换、分解、化合、复分解四种反应类型 |
| B.乙方案中加过量铁粉可以将四种阳离子全部还原 |
| C.丙方案也发生环境污染 |
| D.三种实验方案中都能制得纯净铜 |
某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:

下列判断正确的是 ( )
A.甲方案中的反应涉及到置换、分解、化合、复分解四种反应类型
B.乙方案中加过量铁粉可以将四种阳离子全部还原
C.丙方案也发生环境污染
D.三种实验方案中都能制得纯净铜
某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
下列判断正确的是 ( )
A.甲方案中的反应涉及到置换、分解、化合、复分解四种反应类型
B.乙方案中加过量铁粉可以将四种阳离子全部还原
C.丙方案也发生环境污染
D.三种实验方案中都能制得纯净铜

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com