
题目列表(包括答案和解析)
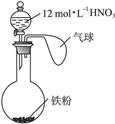
如右图所示,向一定量的铁粉中加入一定体积12 mol·L-1的硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是( )
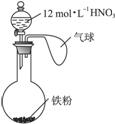
①![]() ②Fe3+ ③H+ ④NO ⑤NO2
②Fe3+ ③H+ ④NO ⑤NO2
A.只有① B.①⑤ C.②④⑤ D.①②③⑤
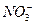 ②Fe3+ ③H+ ④NO ⑤NO2
②Fe3+ ③H+ ④NO ⑤NO2| A.只有① | B.①⑤ | C.②④⑤ | D.①②③⑤ |
右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH 0.1 mol/L 40.00mL | HCl溶液 0.1 mol/L 40.00mL | 5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| …… | …… | …… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为 ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。

( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
|
酸溶液 |
酸溶液 |
气体体积/mL |
反应时间 |
|
|
(实验A) |
(实验B) |
(25℃、101 kPa) |
实验A |
实验B |
|
CH3COOH 0.1 mol/L 40.00mL |
HCl溶液 0.1 mol/L 40.00mL |
5 |
t(a1)=155 s |
t(b1)=7 s |
|
10 |
t(a2)=310 s |
t(b2)=16 s |
||
|
15 |
t(a3)=465 s |
t(b3)=30 s |
||
|
20 |
t(a4)=665 s |
t(b4)=54 s |
||
|
…… |
…… |
…… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为 ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是 (填写符号)。
a.等体积等pH的醋酸和盐酸完全被NaOH溶液中和,消耗NaOH的物质的量一样多
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度比纯水的小
(2)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
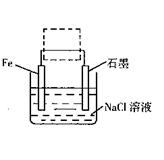
①写出石墨电极的电极反应式 ;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改。
③写出修改后石墨电极的电极反应式 。
(3)①高炉炼铁过程中会发生反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)。
Fe(s)+CO2(g)。
已知:Fe(s)+1/2O2(g)=FeO(s)△H= -272kJ·mol-1
C(s)+O2(g)=CO2(g) △H= -393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H= -22lkJ·mol-1
则:①FeO(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H= 。
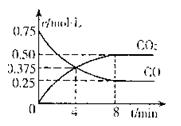
②一定温度下,向某密闭容器中加人足量FeO,
并充人一定量的CO气体,反应过程中CO和CO2的
浓度与时间的关系如图所示则从开始至达到平衡过程中,![]() (CO)= 。
(CO)= 。
(4)铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com