
题目列表(包括答案和解析)
 (2008?淮南一模)实验测得A、B、C三种有机物的相对分子质量均为72.
(2008?淮南一模)实验测得A、B、C三种有机物的相对分子质量均为72. +nCH3OH
+nCH3OH| 催化剂 |
| 加热 |
 +nH2O
+nH2O +nCH3OH
+nCH3OH| 催化剂 |
| 加热 |
 +nH2O
+nH2O(08皖南8校联考)实验测得A、B、C三种有机物的相对分子质量均匀100。
(1)A为含有![]() 个碳原子的烃,每个分子中含有3
个碳原子的烃,每个分子中含有3![]() +1个共价键,则其分子式为______。
+1个共价键,则其分子式为______。
(2)B是含碳60%的烃的含氧衍生物,分子中只有―种官能团,与新制悬浊![]() 悬浊液反应时有红色
悬浊液反应时有红色![]() 生成。则B的可能结构有__________种。
生成。则B的可能结构有__________种。
(3)C能发生如下变化:

已知C的分子结构中两个甲基连接在同一个碳原子上,E和G都是高分子化合物。请按要求填空:
①C的结构简式为________________________________。
②E![]() G的化学方程式为_______________________________________________。
G的化学方程式为_______________________________________________。
此反应类型为________________。
在一容积为10L的密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得A、B、C三种物质的物质的量如下表。据此判断下列结论中不正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| n(A)/mol | 7 | 3 | 1 | 1 |
| n(B)/mol | 5 | 3 | 2 | 2 |
| n(C)/mol | 1 | 3 | 4 | 4 |
A.在容器中发生的反应为:2A+B![]() C B.平衡时A的转化率比B的转化率高
C B.平衡时A的转化率比B的转化率高
C.在该温度下该反应的化学平衡常数K=200
D.在t1~t2内C物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
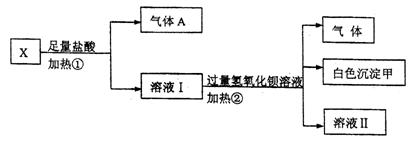
(16分)Ⅰ.某无色溶液X,由K+、 、Ba2+、Al3+、Fe3+、
、Ba2+、Al3+、Fe3+、 、
、 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验:
(1)白色沉淀甲是 。
(2)试写出实验过程中生成气体A、B的离子方程式 、 。
(3)通过上述实验,可确定X溶液中一定存在的离子是 ,要确定可能存在的离子,需补加的实验是 。
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
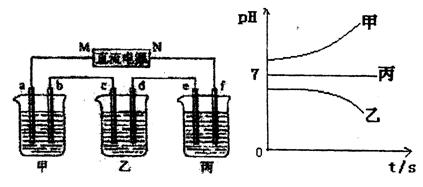
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电 解时间t的关系图如上。据此回答下列问题:
解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 。
(2)计算电极e上生成的气体在标准状况下的体积 ;
(3)写出乙烧杯的电解池反应 。
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。
Ⅰ.某无色溶液X,由K+、![]() 、Ba2+、Al3+、Fe3+、
、Ba2+、Al3+、Fe3+、![]() 、
、![]() 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验:
(1)白色沉淀甲是 。
(2)试写出实验过程中生成气体A、B的离子方程式 、 。
(3)通过上述实验,可确定X溶液中一定存在的离子是 ,要确定可能存在的离子,需补加的实验是 。
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:

下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 。
(2)计算电极e上生成的气体在标准状况下的体积 ;
(3)写出乙烧杯的电解池反应 。
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com