
题目列表(包括答案和解析)

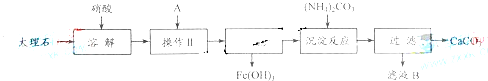


![]() 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
![]()

![]() (1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
(1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
![]() (2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
![]() (3)写出检验滤液中是否含铁离子方程式:_____________________________________
(3)写出检验滤液中是否含铁离子方程式:_____________________________________
![]() ______________________________________________________________________。
______________________________________________________________________。
![]() (4)写出加入碳酸铵所发生反应的离子方程式:________________________________
(4)写出加入碳酸铵所发生反应的离子方程式:________________________________
![]() 写出滤液B的一种用途:_________________________
写出滤液B的一种用途:_________________________
![]() (5)
(5)![]() 中一般含
中一般含![]() 。试按下列提示完成
。试按下列提示完成![]() 含量分析的实验设计。
含量分析的实验设计。
![]() 试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
![]() 实验步骤:
实验步骤:
![]() ①_______;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
①_______;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
![]() (6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________
(13分)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
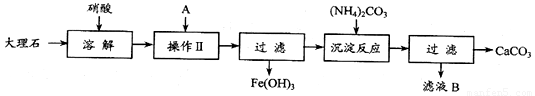
(1)溶解大理石时,用硝酸而不同硫酸的原因是 _____________ 。
(2)操作Ⅱ的目的是 ____ ,溶液A(溶质是共价化合物)是 。
(3)写出检验滤液B中是否含NH4+离子方法: _______
_________________________________________________________________________
(4)写出加入碳酸铵所发生反应的离子方程式: _______ 。写出滤液B的一种用途: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com