
题目列表(包括答案和解析)
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
2NO2+2NaOH====NaNO2+NaNO3+H2O
NO2+NO+2NaOH====2NaNO2+H2O
(1)若在标准状况下有NO、NO2的混合物恰好与50 mL 2.0 mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4∶1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离。若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价,硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×109 L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,所得利润y(出售价减去成本价,单位:万元)与x的关系为______________。(附解题过程)
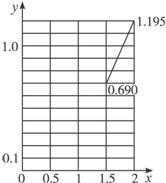
(3)根据(2)的计算结果,在以下坐标系中作出其示意图。
硝酸工业尾气中的氮的氧化物(NO、NO2)是主要的大气污染物,其常用的治理方法有以下两种(已简化)
①NaOH吸收法反应原理如下:2 NO2+2NaOH=NaNO3+NaNO2+H2O;NO+NO2+2NaOH=2NaNO2+ H2O
②氨催化还原法 反应原理是:NO2+NH3→N2+H2O
现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体);若用过量的NaOH溶液吸收后溶液中 NaNO3与 NaNO2的物质的量之比恰好与尾气中NO和 NO2的物质的量之比相等。
(1)若用NOx表示该尾气中氮的氧化物的平均组成,试求x的值。
(2)将1体积的该尾气用氨催化还原法处理,至少消耗相同状况下多少体积的氨气?
(10分)硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3 = NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3 = 2NaNO2+CO2↑ ②
(1)若在标准状况下有NO、NO2的混合物恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用纯碱溶液吸收,生成硝酸钠及亚硝酸钠再结晶分离。
①若该混合气体通入纯碱溶液时要求被完全吸收,则x的取值范围应为 。
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×106m3(标准状况)含NOx(x取值范围满足①中要求)体积分数为0.1%的尾气,求所得利润y(出售价减去成本价,单位:万元)与x的关系式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com