
题目列表(包括答案和解析)
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )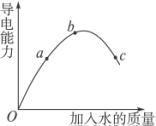
(1)图中O点时导电能力为0,其理由是_________________________________________。
(2)a、b、c三点对应溶液的c(H+)由小到大的顺序为_______________________________。
(3)a、b、c三点对应溶液中,醋酸电离程度最大的是______________________________。
(4)试说明醋酸的导电能力与加水量变化的原因:_________________________________。
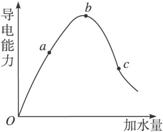
(1)“O”点导电能力为0的理由________________。
(2)a、b、c三点溶液的pH由小到大的顺序为__________________。
(3)a、b、c三点中电离度最大的是___________________________。
(4)若使c点溶液的c(CH3COO-)增大,溶液的pH也增大,可采取的措施为①____________________;②____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com