
题目列表(包括答案和解析)
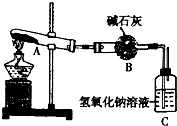 (2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示. (2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示.
|
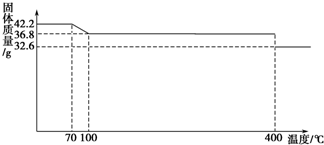
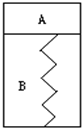 如图所示,某刚性容器内有一活塞和弹簧,B为真空,A内已充入2molSO2和1molO2,在一定条件下发生可逆反应2SO2+O2?2SO3;△H=-QkJ/mol,(Q>0)一段时间后活塞已保持静止,SO2的反应速率为Υ0.再往A内迅速充入2molSO2和1molO2,当活塞再次保持静止时,SO2的反应速率为Υ,在此过程中,下列说法正确的是( )
如图所示,某刚性容器内有一活塞和弹簧,B为真空,A内已充入2molSO2和1molO2,在一定条件下发生可逆反应2SO2+O2?2SO3;△H=-QkJ/mol,(Q>0)一段时间后活塞已保持静止,SO2的反应速率为Υ0.再往A内迅速充入2molSO2和1molO2,当活塞再次保持静止时,SO2的反应速率为Υ,在此过程中,下列说法正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com