煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH
3OH 是最重要的研究方向之一.

(1)在2L的密闭容器中,由CO
2和H
2合成甲醇CO
2(g)+3H
2(g)═CH
3OH(g)+H
2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如图1所示(注:T
2>T
1均大于300℃).
①温度为T
2时,从反应开始到平衡,生成甲醇的平均反应速率为
②通过分析图1,可以得出温度对反应CO
2(g)+3H
2(g)═CH
3OH(g)+H
2O(g)的影响可以概括为
③下列情形能说明上述反应已达到平衡状态的是
a.体系压强保持不变.
b.密闭容器中CO
2、H
2、CH
3OH(g)、H
2O(g)4种气体共存
c.CH
3OH与H
2物质的量之比为1:3.
d.每消耗1mol CO
2的同时生成3molH
2④已知H
2(g)和CH
3OH(l)的燃烧热△H分别为-285.8kJ?mol
-1和-726.5kJ?mol
-1,写出由CO
2和H
2生成液态甲醇和液态水的热化学方程式
.
(2)在容积可变的密闭容器中,由CO和H
2合成甲醇CO(g)+2H
2(g)═CH
3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示.
①该反应的平衡常数表达式为K=
,250℃、0.5×10
4kPa下的平衡常数
300℃、1.5×10
4kPa下的平衡常数(填“>”、“<”或“=”)
②工业实际生产中,该反应条件控制在250℃、1.3×10
4kPa左右,选择此压强而不选择更高压强的理由是
③在图2中画出350℃时CO的平衡转化率随压强变化的大致曲线.

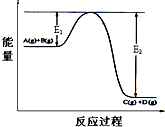 反应A(g)+B(g)?2C(g)+D(g);△H=Q kJ/mol.过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?2C(g)+D(g);△H=Q kJ/mol.过程中的能量变化如图所示,回答下列问题.