
题目列表(包括答案和解析)
图5装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
| 选项 | 试剂 | 现象 | 结论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红后不褪色 | SO2有酸性、没有漂白性 |

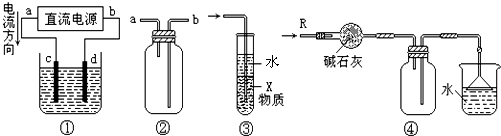
| A、装置④可用于干燥、收集氨气,并吸收多余的氨气 | B、装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO、NO2等气体 | C、装置①中,d为阳极、c为阴极 | D、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
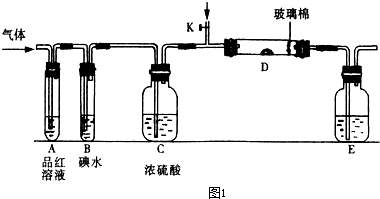
| ||
| △ |
| ||
| △ |

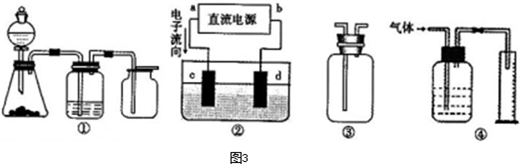
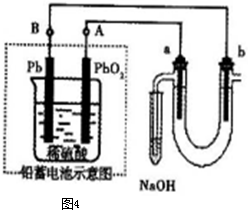
 (2013?闸北区二模)如图装置可用于收集气体并验证其化学性质, (2013?闸北区二模)如图装置可用于收集气体并验证其化学性质,
|
 ??????
??????湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com