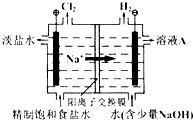
氯碱工业中电解饱和食盐水的原理示意图如图所示:
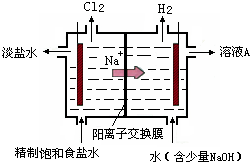
(1)由于生成的氯气可溶于水,并发生下列反应Cl
2+H
2O?HCl+HClO,电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出
氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出
;
(2)电解所用的盐水需精制.去除食盐水中含有的Ca
2+、Mg
2+、NH
4+、SO
42-[c(SO
42-)>c(Ca
2+)].精致流程如下(淡盐水和溶液A来上述电解池):
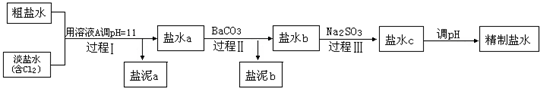
①盐泥a除泥沙外,还含有的物质是
Mg(OH)2
Mg(OH)2
.
②过程Ⅰ中Cl
2将NH
4+转化为N
2的离子方程式是
2NH4++3Cl2+8OH-=N2+6Cl-+8H2O或2NH4++3ClO-+2OH-=N2+3Cl-+5H2O
2NH4++3Cl2+8OH-=N2+6Cl-+8H2O或2NH4++3ClO-+2OH-=N2+3Cl-+5H2O
.
③BaSO
4的溶解度比BaCO
3的小,过程Ⅱ中除去的离子有
Ca2+、SO42-
Ca2+、SO42-
.
④经过程Ⅲ处理,要求盐水c中剩余Na
2SO
3的含量小于5mg/L,若盐水b中NaClO的含量是7.45mg/L,则处理10m
3盐水b,最多添加10%Na
2SO
3溶液的质量为多少kg?(加入溶液引起的体积变化忽略不计,请写出解题步骤).
1.76kg
1.76kg
.



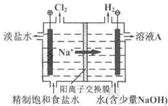 (2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
(2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示. HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出 HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出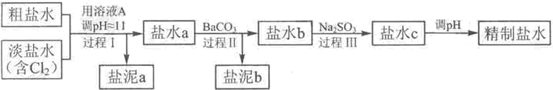
 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示: