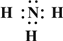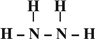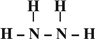
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(1)L的元素名称为
氧
氧
;五种元素的原子半径从小到大的顺序是(用元素符号表示)
H<O<N<C<Al
H<O<N<C<Al
.
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程
3H?+
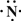
→
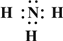
3H?+
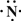
→
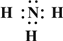
,B的结构式
.
(3)硒(Se)是人体必须的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
34
34
,其最高价氧化物对应的水化物化学式为
H2SeO4
H2SeO4
.该族2~5周期元素单质分别与H
2反应生成1mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是
b
b
(填字母代号).a.+99.7kJ?mol
-1 b.+29.7kJ?mol
-1c.-20.6kJ?mol
-1 d.-241.8kJ?mol
-1(4)一定条件下,M与TiO
2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知.该反应生成lmol乙时放出536kJ热量,其热化学方程式为
4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)△M=-1072g/mol
4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)△M=-1072g/mol
.
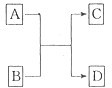
(二)已知A、B、C、D分别是由短周期元素原子组成的四种微粒,它们之间有如图所示的转变关系,且A是种含有18电子的微粒,C是一种含有10电子的微粒.请完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式
2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2
.
(2)若B、D属同主族的单质分子,写出C的化学式
H2O
H2O
.
(3)若B是一种含四核l8电子的分子,如果D是一种气态单质分子,B的结构简式为
H-O-O-H
H-O-O-H
.
(4)若A、B均是含2个原子核的微粒,其中B中含有10个电子,D中含有18个电子,则A、B之间发生的离子反应方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.
(5)若D是一种含有22电子的分子,则符合如图关系的A的物质有
CH3OH、CH3-CH3
CH3OH、CH3-CH3
(写出物质的化学式,如果是有机物则写相应的结构简式).

 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题: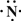 →
→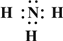
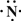 →
→