
题目列表(包括答案和解析)
| H2SO4 |
| NaOH |
| NaOH |
| AlO | - 2 |
| H2SO4 |
|

| Al2O3 | Fe2O3 | 其他杂质 | |
| 铝土矿 | 55% | 16% | - |
| 赤泥 | 15% | 48% | 一 |
铝是国民经济发展的重要材料,铝在地壳中的含量约占8% ,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:
方案3 : o
o
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图16所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
|
|
Al2O3 |
Fe2O3 |
其他杂质 |
|
铝土矿 |
55% |
16% |
— |
|
赤泥 |
15% |
48% |
一 |
(1) 书写化学方程式,反应①_________,反应②________________
(2) 电解氧化铝生产铝时,阳极的电极反应式为________________。
(3) 假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿________t
能源是现代社会发展的三大支柱之一。化学在提高能源的利用率和开发新能源中起到了重要的作用。
(1)下列说法中,正确的是 。(填序号)
| A.煤、石油和天然气都是可再生的能源 |
| B.目前使用的手机电池为二次电池,放电时是将化学能转化为电能 |
| C.人体运动所消耗的能量与化学反应无关 |
| D.人类目前所直接利用的能量大部分是由化学反应产生的 |
铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:
方案3 :
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图所示:
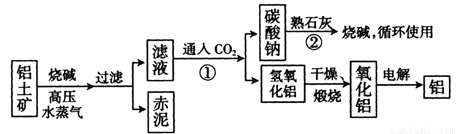
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
|
|
Al2O3 |
Fe2O3 |
其他杂质 |
|
铝土矿 |
55% |
16% |
— |
|
赤泥 |
15% |
48% |
一 |
(1) 书写化学方程式,反应①_______ ,
反应②______________ __
(2) 电解氧化铝生产铝时,阳极的电极反应式为____________ _。
(3) 假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿______ __t
能源是现代社会发展的三大支柱之一。化学在提高能源的利用率和开发新能源中起到了重要的作用。
(1)下列说法中,正确的是 。(填序号)
A.煤、石油和天然气都是可再生的能源
B.目前使用的手机电池为二次电池,放电时是将化学能转化为电能
C.人体运动所消耗的能量与化学反应无关
D.人类目前所直接利用的能量大部分是由化学反应产生的
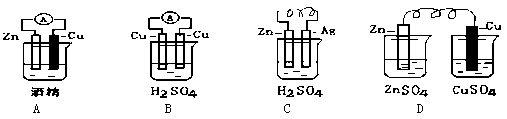
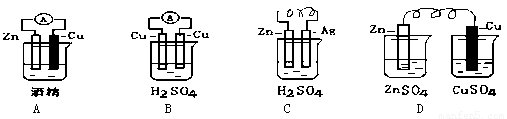
(2)电能是现代社会中应用最广泛的二次能源,下列装置中能够实现化学能转化为电能的是 (填序号)。写出该装置正极反应的电极反应式
(3)锌锰干电池是目前使用最广泛的一种电池,其正极材料是石墨棒,它在放电时总反应式可表示为:Zn+ 2 MnO2 + 2 NH4+ ="=" Zn2+ + Mn2O3(S)+ 2NH3 + H2O。写出该电池负极反应的电极反应式 。当电极锌消耗6.5g时,可对外提供的电子是 mol。
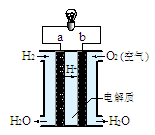
(4)右图是氢氧燃料电池构造示意图(电解质溶液为稀硫酸)。关于该电池的说法不正确的是
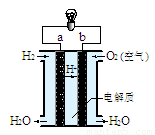
①.a极是负极
②.正极的电极反应是:O2+2H2O+4e-=4OH-
③.该装置可以将化学能完全转化为电能
④.氢氧燃料电池是环保电池
(5)人类在使用能源的过程中会产生环境问题。利用化学反应可以有效的进行治理。减少汽车等机动车尾气污染可在汽车尾气系统中增加催化转化装置,尾气中的CO、NO在催化剂的作用下反应生成两种参与大气循环的无毒气体,写出该反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com