
题目列表(包括答案和解析)
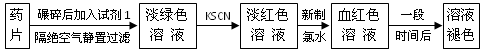
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物.该药品不溶于水但能溶于人体中的胃酸.某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
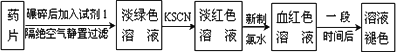
(1)试剂1是________,加入新制氯水后溶液中发生的离子反应方程式是:
________,________;
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了淡红色,其可能的原因是________;
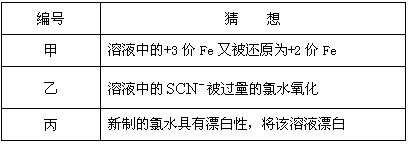
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:

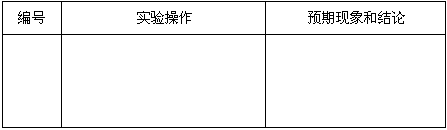
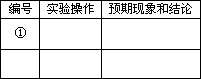
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)

 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O  Cr(OH)3(s)
Cr(OH)3(s) Cr3+(紫色) + 3OH-。下列有关说法中正确的是__________
Cr3+(紫色) + 3OH-。下列有关说法中正确的是__________工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.该法的工艺流程为
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
1.若平衡体系的pH=2,则溶液显________色.
2.能说明第①步反应达平衡状态的是________.
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
d.溶液的pH值不变
3.第②步中,还原0.01 mol Cr2O72-离子,需要________mol的FeSO4·7H2O.
4.许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H++CrO2-(亮绿色)+H2O![]() Cr(OH)3(s)
Cr(OH)3(s)![]() Cr3+(紫色)+3OH-
Cr3+(紫色)+3OH-
下列有关说法中正确的是________
a、加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b、在一定条件下存在:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c、Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中的存在叁个平衡
(13分)组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有____(写元素符号),它的基态原子核外电子排布式是 ,其第一电离能比O的________(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置 。
(2)CO2是一种温室气体,它的电子式为 ,将其转变其他化工原料,必须破坏的化学键属于 (填“极性”或“非极性”)键。
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是____(填序号)。
a.离子半径:S2-> Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com