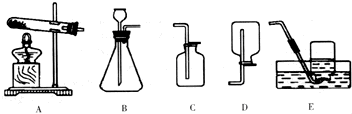
中考化学实验考查其中的一个内容是:用大理石和稀盐酸制取、收集CO
2并检验,下列仪器组装成发生装置应选用
B
B
(填序号).收集装置只能选择
C
C
(填序号),依据是
二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集
二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集
.不改变收集和发生装置还可制取并收集
氧气
氧气
气体,化学方程式为
.
实验结束后同学们将试管中的“废液”倒入废液缸.几位同学对此产生了兴趣:
(1)天天看到大理石留在了漏斗中,液体流入了试剂瓶,此操作是利用了
过滤
过滤
法对混合物分离的.
(2)强强用
PH试纸
PH试纸
测得试剂瓶中液体的PH为1,由此推断液体中一定含有溶于水的氯化钙、水和
盐酸
盐酸
三种物质.
(3)月月将一颗生锈的铁钉放入少量废液中,开始看到铁锈消失,溶液变黄.化学方程式为
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
,一段时间后还能看到
有气泡冒出
有气泡冒出
.
(4)艺艺想对废液先处理,然后回收氯化钙.她忽然想到,如果把检验CO
2后集气瓶内变浑浊的“石灰水”与废液按一定比例混合就能达到预期效果.
①首先用实验确认集气瓶内变浑浊的“石灰水”的成分:
| 操 作 |
现 象 |
结 论 |
先向集气瓶内变浑浊的“石灰水”中,滴加无色酚酞试液, 先向集气瓶内变浑浊的“石灰水”中,滴加无色酚酞试液, |
发现无色变红色,仍浑浊 发现无色变红色,仍浑浊 |
(1)仍有没反应的氢氧化钙
(2)还含有生成的碳酸钙 |
②如何确认集气瓶内变浑浊的“石灰水”与废液恰好完全反应呢?
她取少量集气瓶内变浑浊的“石灰水”于试管中,滴加几滴无色酚酞试液后变红,逐滴加入废液,看到
无气泡生成,溶液变为无色
无气泡生成,溶液变为无色
现象时说明恰好反应,其中氢氧化钙与废液发生反应的方程式
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
.
③从反应后的溶液中获取氯化钙晶体可采用
蒸发结晶的
蒸发结晶的
方法.

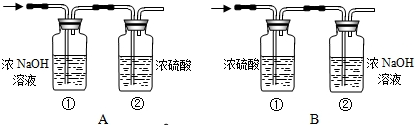
 空气是多种气体组成的混合物,氧气约占21%,氮气约占78%.测定空气中氧气含量的基本思路是:取一定体积的混合气体
空气是多种气体组成的混合物,氧气约占21%,氮气约占78%.测定空气中氧气含量的基本思路是:取一定体积的混合气体
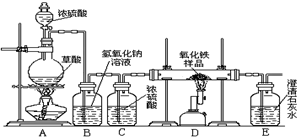 化学小组的同学在研究性学习课上展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应,且杂质中不含铁).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
化学小组的同学在研究性学习课上展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应,且杂质中不含铁).查阅资料:草酸在浓硫酸存在时加热发生如下反应: