
题目列表(包括答案和解析)
请结合下列实验常用装置,回答有关问题。
 | 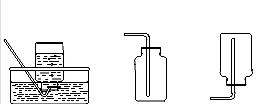 | ||
A B C D E F
① 写出仪器a的名称: (1) 。
② 若用氯酸钾和二氧化锰制取氧气,该反应的化学方程式是 (2) ,二氧化锰在此反应中的作用是 (3) 。将装置A和D连接进行此实验,实验结束,停止加热前要先将导管移出水面,目的是 (4) 。
③ 若用块状石灰石和稀盐酸制取二氧化碳,选用的装置组合是 (5) (填字母编号),在加试剂之前的操作是 (6) 。将收集到的二氧化碳气体通入盛有蒸馏水的试管,一段时间后,测得该试管中溶液的pH (7) (填“>”、“<”或“=”)7,对该现象的合理解释为 (8) (用化学方程式表示)。
④ C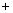 O2
O2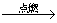 CO2是我们最熟悉的反应,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是 (9) (写出 1条)。
CO2是我们最熟悉的反应,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是 (9) (写出 1条)。
⑤ 某同学用石灰石和稀盐酸完成“制取并检验CO2”的实验,消耗了73克10%的盐酸。计算实验过程中产生CO2的物质的量是多少? (10)
地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
| 密度/g·cm-3) | 1.01 | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
| 溶质质量分数/% | 1 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 98 |
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃—30 ℃)
| 温度/℃ 物质 | 0 | 10 | 20 | 30 |
| 氯化钠 | 35.7 g | 35.8 g | 36 g | 36.3 g |
| 碳酸钠晶体 | 7 g | 12.5 g | 21.5 g | 38.8 g |
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是:________________________________________________。
(2)由表二可得出两种物质溶解度差异的规律是:____________________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:__________________________________________________________。
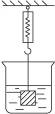
(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
| 密度/g·cm-3) | 1.01 | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
| 溶质质量分数/% | 1 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 98 |
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃—30 ℃)
| 温度/℃ 物质 | 0 | 10 | 20 | 30 |
| 氯化钠 | 35.7 g | 35.8 g | 36 g | 36.3 g |
| 碳酸钠晶体 | 7 g | 12.5 g | 21.5 g | 38.8 g |
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是:________________________________________________。
(2)由表二可得出两种物质溶解度差异的规律是:____________________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:__________________________________________________________。

(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
| 密度/g·cm-3) | 1.01 | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
| 溶质质量分数/% | 1 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 98 |
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃—30 ℃)
| 温度/℃ 物质 | 0 | 10 | 20 | 30 |
| 氯化钠 | 35.7 g | 35.8 g | 36 g | 36.3 g |
| 碳酸钠晶体 | 7 g | 12.5 g | 21.5 g | 38.8 g |
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是:________________________________________________。
(2)由表二可得出两种物质溶解度差异的规律是:____________________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:_________________________________________________________。

(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
以下是有关CO2溶解度的几组数据:
①一个标准大气压时CO2在某些溶剂中的溶解度(单位:m L/g)
|
   | -60 | -40 | -20 | 0 | 20 | 30 | ||
| 甲醇 | 66 | 24.5 | 11.4 | 6.3 | 4.1 | 3.6 | ||
| 丙酮 | 127 | 50 | 24 | 13 | 8.2 | 6.6 | ||
| 甲苯 | 8.7 | 4.4 | 4.0 | 3.5 | 3.0 | 2.8 |
②CO2在水中的溶解度(单位:m L/g)
| 压强 /大气压 | 温度/℃ | ||||
| 0 | 25 | 50 | 75 | 100 | |
| 1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
| 10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
| 25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
请根据数据分析:
(1)影响CO 2的溶解度的因素有 、 和 。
(2)根据CO 2在水中的溶解度表,简单说明外界条件是如何影响气体溶解度的?
(3)打开汽水瓶有CO 2气体溢出,说明瓶中的压强 (填:大于、小于或等于)瓶外大气压强。
(4)如果用排水集气法收集CO 2时,可采取 的措施。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com