
题目列表(包括答案和解析)
学习了金属的化学性质后,某兴趣小组进行了如下实验:将足量镁条加入到氯化铜溶液 中,观察到镁条表面有气泡产生,同时有红色固体附在镁条表面。
【提出问题】产生气体是什么物质? 有红色固体又是什么物质?
【查阅资料】在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2O
反应生成的NO是无色、难溶于水的气体,在常温下与空气中的O2迅速化合生成 N02,N02是红棕色、有刺激性气味的有毒气体。
【作出猜想】猜想一:气体可能是氢气、红色固体是金属氧化铁;猜想二:气体可能是氢气、 红色固体是金属铜;猜想三:气体可能是二氧化碳、红色固体是金属铜。
【交流讨论】大家思考后,一致认为猜想一和三不合理,其理由是_____________________。
【实验与结论】
| 实验步骤 | 现象 | 结论 |
| (1)取少量红色固体于一支洁净的试管中,加入稀盐酸 | __________________________________ | 猜想一不成立 |
| (2)①用尖嘴导管将气体导出并引燃,同时在上方放一块干冷的玻璃片 ②取少量红色固体于一支洁净的试管中,加入稀硝酸 | 该气体能燃烧,且玻璃片上有______出现 红色固体溶解,得到蓝色溶液同时看到试管上部有红棕色气体产生 | 猜想二成立 |
| 实验步骤 | 现象 | 结论 |
| (1)取少量红色固体于一支洁净的试管中,加入稀盐酸 | __________________________________ | 猜想一不成立 |
| (2)①用尖嘴导管将气体导出并引燃,同时在上方放一块干冷的玻璃片 ②取少量红色固体于一支洁净的试管中,加入稀硝酸 | 该气体能燃烧,且玻璃片上有______出现 红色固体溶解,得到蓝色溶液同时看到试管上部有红棕色气体产生 | 猜想二成立 |
物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
(1)用pH试纸测定溶液的pH时,正确的操作是:________________.
(2)简述强调“测得的pH小于7”的理由:________________.
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是________________.实验结果表明酚酞溶液红色消失与空气中的氧气无关.
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈________性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关.
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法________,②观察到的现象________.
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值Δt(如下表).

(1)表中x=________.
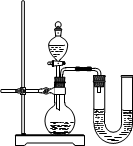
(2)某同学在没使用温度计的情况下,通过如图所示装置完成了实验.则该同学根据________________判断NaOH溶液与稀盐酸发生了中和反应.
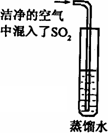
雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:
(1)要测定某地采集到的雨水是否为酸雨,下列提供的试剂(试纸)中宜取用________
A.蓝色石蕊试纸
B.紫色石蕊溶液
C.无色酚酞试剂
D.pH试纸
(2)已知CO2的饱和溶液常温下pH不小于5.6.通常空气中CO2的含量大于SO2的含量,但人们反而将空气中的SO2认定为形成酸雨的主要原因之一.有同学想通过如下图的实验寻找证据,你认为下一步的实验步骤是测定________,只要出现________的实验结果,就可认定SO2溶于水有形成酸雨的可能.
(3)已知SO2与CO2有许多化学性质是相似的,亚硫酸钙(CaSO3)是白色难溶于水但可溶于酸的固体.某同学向一酸雨样品中滴加CaCl2,溶液本观察到有浑浊现象,继续滴入NaOH溶液后即有白色沉淀产生.在以上实验过程中,下列不可能发生的化学反应是________
A.SO2+CaCl2+H2O![]() CaSO3↓十2HCI
CaSO3↓十2HCI
B.SO2+2NaOH![]() Na2SO3+H2O
Na2SO3+H2O
C.Na2SO3+CaCl2=CaSO3↓+2NaCI
D.H2SO3+2NaOH=Na2SO3+2H2O
实验探究让化学更具魅力,请帮助完成下列实验探究
(1)同学们在做完“二氧化碳的实验室制取”后,对废液进行了如下处理:过滤,取滤液于烧杯中,逐滴滴入Na2CO3溶液至过量.
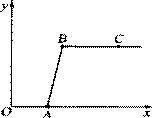
记录滴入Na2CO3溶液质量(x)与有关的变化关系如图
所示.图中纵坐标(y)表示_______________,AB段
发生反应的化学方程式是___________________ _____,
_____,
反应进行到A点时,溶液中的溶质是______________,
 C点时溶液的 pH___ _(填“>”“<”“=”)7.
C点时溶液的 pH___ _(填“>”“<”“=”)7.
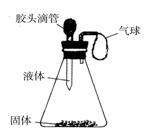
 (2)如图所示,一同学挤压胶头滴管中的液体,
(2)如图所示,一同学挤压胶头滴管中的液体,
使之与瓶中固体接触,小气球鼓了起来。
请写出符合这一现象的化学方程式:
①置换反应_____________________ __;
__;
②化合反应_________________________。
(3)实验室中,同学们发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
①对白色粉末成分的猜想和成因分析:
| 白色粉末的成分 | 形 |
| 可能是CaCO3 | 石灰水与空气中CO2反应: 化学方程式为: |
| 可能是 | 随着气温的升高,溶质的溶解度会 (填变大或变小)或溶剂蒸发,石灰水中的溶质析出 |
经过反复思考,同学们认为白色粉末还可能是以上两种物质的混合物.
②设计实验:甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,于是他得出粉末中只有CaCO3的结论。乙同学查阅了溶解性表,认为甲同学的结论不严密,理由是: 。
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实 验 步 骤 | 可能观察到的现象 | 结 论 |
| 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 溶液变红 |
|
| 往上述试管内残留的固体中加入 |
| 白色粉末中含有CaCO3 |
③交流与反思
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是 。A.密封保存 B.使用前,临时配制 (填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com