
题目列表(包括答案和解析)
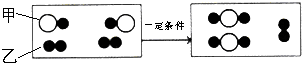 质量守恒定律的定量研究对化学科学发展具有重大意义.
质量守恒定律的定量研究对化学科学发展具有重大意义. ”聚集成的物质
”聚集成的物质
| ||
| ||
 质量守恒定律的定量研究对化学科学发展具有重大意义.
质量守恒定律的定量研究对化学科学发展具有重大意义. ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: ”聚集成的物质
”聚集成的物质
| ||
| ||
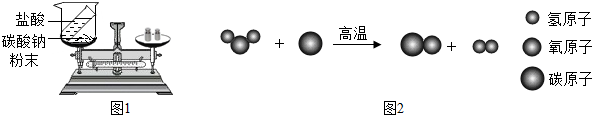
| 反应前后质量组别 | 甲组 | 乙组 | 丙组 |
| 盐酸与碳酸钠粉末反应前称量(g) | 85.3 | 82.8 | 86.5 |
| 盐酸与碳酸钠粉末反应后称量(g) | 85.3 | 80.6 | 87.8 |
 质量守恒定律的定量研究对化学科学发展具有重大意义.
质量守恒定律的定量研究对化学科学发展具有重大意义. ”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的甲、乙两种反应物分子的个数比为______,此反应的基本反应类型为______,任举一例符合此反应类型的化学方程式______.
”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的甲、乙两种反应物分子的个数比为______,此反应的基本反应类型为______,任举一例符合此反应类型的化学方程式______.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com